แบตเตอรี่เป็นแหล่งพลังงานที่พบบ่อยที่สุดสำหรับอุปกรณ์พกพาขั้นพื้นฐานไปจนถึงงานอุตสาหกรรมขนาดใหญ่ แบตเตอรี่สามารถกำหนดได้เนื่องจากเป็นการรวมกันของเซลล์ไฟฟ้าเคมีหนึ่งเซลล์ขึ้นไปที่สามารถแปลงพลังงานเคมีที่จัดเก็บไว้เป็นพลังงานไฟฟ้าได้

การทำงานของแบตเตอรี่:
แบตเตอรี่เป็นอุปกรณ์ซึ่งประกอบด้วยเซลล์โวลตาอิกต่างๆ เซลล์โวลตาอิกแต่ละเซลล์ประกอบด้วยเซลล์ครึ่งเซลล์สองเซลล์ที่เชื่อมต่อกันเป็นอนุกรมโดยอิเล็กโทรไลต์ที่เป็นสื่อกระแสไฟฟ้าซึ่งถือแอนไอออนและไอออนของแมว ครึ่งเซลล์หนึ่งประกอบด้วยอิเล็กโทรไลต์และอิเล็กโทรดที่แอนไอออนเคลื่อนที่เช่นขั้วบวกหรือขั้วลบอีกครึ่งเซลล์ประกอบด้วยอิเล็กโทรไลต์และอิเล็กโทรดที่ไอออนของแมวเคลื่อนที่เช่นแคโทดหรืออิเล็กโทรดบวก
ในปฏิกิริยารีดอกซ์ที่ให้พลังงานกับแบตเตอรี่การลดลงจะเกิดขึ้นกับไอออนบวกที่แคโทดในขณะที่ออกซิเดชั่นเกิดขึ้นกับแอนไอออนที่ขั้วบวก อิเล็กโทรดไม่สัมผัสกัน แต่เชื่อมต่อด้วยอิเล็กโทรไลต์ ส่วนใหญ่ครึ่งเซลล์มีอิเล็กโทรไลต์ที่แตกต่างกัน ทุกสิ่งที่พิจารณาทุกครึ่งเซลล์จะอยู่ในภาชนะและตัวคั่นที่มีรูพรุนถึงไอออน แต่ไม่ใช่อิเล็กโทรไลต์จำนวนมากป้องกันการผสม

การทำงานของแบตเตอรี่
ครึ่งเซลล์แต่ละเซลล์มีแรงเคลื่อนไฟฟ้า (Emf) ซึ่งพิจารณาจากความสามารถในการขับเคลื่อนกระแสไฟฟ้าจากภายในสู่ภายนอกของเซลล์ แรงเคลื่อนไฟฟ้าสุทธิของเซลล์คือผลต่างระหว่างแรงเคลื่อนไฟฟ้าของครึ่งเซลล์ ด้วยวิธีนี้หากอิเล็กโทรดมีแรงเคลื่อนไฟฟ้าและกล่าวอีกนัยหนึ่งแรงเคลื่อนไฟฟ้าสุทธิคือความแตกต่างระหว่างศักยภาพในการลดของครึ่งปฏิกิริยา
วิธีดูแลรักษาแบตเตอรี่
เพื่อรักษาแบตเตอรี่ให้อยู่ในสภาพดีจำเป็นต้องมีการปรับสมดุลแบตเตอรี่ เนื่องจากความชราภาพเซลล์ทั้งหมดจึงไม่คิดค่าบริการในทำนองเดียวกันและเซลล์บางชนิดจะรับประจุไฟฟ้าได้เร็วมากในขณะที่เซลล์อื่น ๆ จะค่อยๆ การปรับสมดุลสามารถทำได้โดยการชาร์จแบตเตอรี่เล็กน้อยเพื่อให้เซลล์ที่อ่อนแอกว่าสามารถชาร์จได้อย่างสมบูรณ์ แรงดันไฟฟ้าขั้วของแบตเตอรี่ที่ชาร์จจนหมดคือ 12V แบตเตอรี่รถยนต์แสดง 13.8V ที่ขั้วในขณะที่แบตเตอรี่ท่อ 12 โวลต์จะแสดง 14.8V ควรยึดแบตเตอรี่รถยนต์ไว้ในรถอย่างแน่นหนาเพื่อหลีกเลี่ยงการสั่น ควรวางแบตเตอรี่อินเวอร์เตอร์ไว้บนแผ่นไม้ถ้าเป็นไปได้
แบตเตอรี่ 2 ประเภท
1) แบตเตอรี่หลัก:
ตามชื่อระบุว่าแบตเตอรี่เหล่านี้มีไว้สำหรับการใช้งานครั้งเดียว เมื่อใช้แบตเตอรี่เหล่านี้แล้วจะไม่สามารถชาร์จใหม่ได้เนื่องจากอุปกรณ์ไม่สามารถย้อนกลับได้ง่ายและวัสดุที่ใช้งานอยู่อาจไม่กลับคืนสู่รูปแบบเดิม ผู้ผลิตแบตเตอรี่ไม่แนะนำให้ชาร์จเซลล์หลัก
ตัวอย่างบางส่วนสำหรับแบตเตอรี่แบบใช้แล้วทิ้ง ได้แก่ แบตเตอรี่ AA, AAA ปกติที่เราใช้ในนาฬิกาแขวนรีโมทโทรทัศน์เป็นต้นชื่ออื่นของแบตเตอรี่เหล่านี้คือแบตเตอรี่แบบใช้แล้วทิ้ง

ประเภทแบตเตอรี่
2) แบตเตอรี่สำรอง:
แบตเตอรี่สำรองเรียกอีกอย่างว่าแบตเตอรี่แบบชาร์จไฟได้ แบตเตอรี่เหล่านี้สามารถใช้และชาร์จใหม่ได้พร้อมกัน โดยปกติจะประกอบเข้ากับวัสดุที่ใช้งานและมีการใช้งานอยู่ในสถานะที่ปล่อยออกมา แบตเตอรี่แบบชาร์จได้จะชาร์จใหม่โดยใช้กระแสไฟฟ้าซึ่งจะย้อนกลับปฏิกิริยาทางเคมีที่เกิดขึ้นระหว่างการคายประจุ เครื่องชาร์จเป็นอุปกรณ์ที่จ่ายกระแสไฟฟ้าที่ต้องการ
ตัวอย่างบางส่วนของแบตเตอรี่แบบชาร์จได้เหล่านี้ ได้แก่ แบตเตอรี่ที่ใช้ในโทรศัพท์มือถือเครื่องเล่น MP3 เป็นต้นอุปกรณ์ต่างๆเช่นเครื่องช่วยฟังและนาฬิกาข้อมือใช้เซลล์ขนาดเล็กและในสถานที่ต่างๆเช่นชุมสายโทรศัพท์หรือศูนย์ข้อมูลคอมพิวเตอร์จะใช้แบตเตอรี่ขนาดใหญ่ขึ้น

แบตเตอรี่สำรอง
ประเภทของแบตเตอรี่สำรอง (ชาร์จใหม่ได้):
SMF กรดตะกั่ว Li และ Nicd
แบตเตอรี่ SMF:
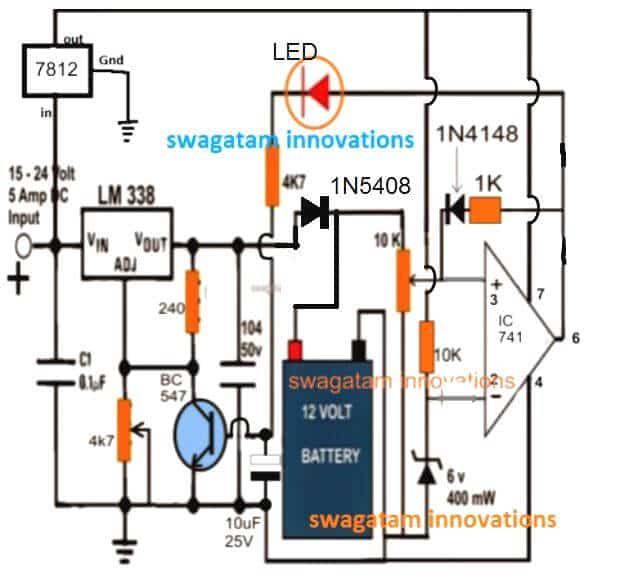
SMF คือ แบตเตอรี่ที่ไม่ต้องบำรุงรักษาแบบปิดผนึกออกแบบมาเพื่อให้มีกำลังบำรุงรักษาที่เชื่อถือได้สม่ำเสมอและต่ำสำหรับการใช้งาน UPS แบตเตอรี่เหล่านี้อาจมีการใช้งานรอบลึกและการบำรุงรักษาขั้นต่ำในพื้นที่ชนบทและพื้นที่ขาดพลังงาน แบตเตอรี่เหล่านี้มีจำหน่ายตั้งแต่ 12V
ในโลกแห่งข้อมูลในปัจจุบันเราไม่สามารถมองข้ามข้อกำหนดสำหรับระบบแบตเตอรี่ที่ออกแบบมาเพื่อกู้คืนข้อมูลและข้อมูลที่มีคุณสมบัติสำคัญและเรียกใช้เครื่องมือพื้นฐานสำหรับระยะเวลาที่ต้องการ ต้องใช้แบตเตอรี่เพื่อส่งพลังงานทันที แบตเตอรี่ที่ไม่น่าเชื่อถือและด้อยคุณภาพอาจส่งผลให้สูญเสียข้อมูลและการปิดเครื่องซึ่งอาจทำให้ บริษัท สูญเสียทางการเงินอย่างมาก ต่อจากนั้นกลุ่ม UPS จึงเรียกร้องให้ใช้ระบบแบตเตอรี่ที่เชื่อถือได้และได้รับการพิสูจน์แล้ว

แบตเตอรี่ SMF
แบตเตอรี่ลิเธียม (Li):
เราทุกคนใช้มันในอุปกรณ์พกพาเช่นโทรศัพท์มือถือคอมพิวเตอร์แล็ปท็อปหรือเครื่องมือไฟฟ้า แบตเตอรี่ลิเธียมเป็นหนึ่งในความสำเร็จที่ยิ่งใหญ่ที่สุดในด้านพลังงานแบบพกพาในช่วงทศวรรษที่ผ่านมาด้วยการใช้แบตเตอรี่ลิเธียมเราสามารถเปลี่ยนจากโทรศัพท์มือถือขาวดำเป็นโทรศัพท์มือถือแบบมีสีพร้อมคุณสมบัติเพิ่มเติมเช่น GPS การแจ้งเตือนทางอีเมลเป็นต้นสิ่งเหล่านี้สูง อุปกรณ์ที่มีศักยภาพความหนาแน่นของพลังงานสำหรับความจุที่สูงขึ้น และแบตเตอรี่ที่ปลดปล่อยตัวเองค่อนข้างต่ำ นอกจากนี้เซลล์พิเศษยังสามารถให้กระแสไฟฟ้าสูงมากสำหรับการใช้งานเช่นเครื่องมือไฟฟ้า

Li แบตเตอรี่
แบตเตอรี่นิกเกิลแคดเมียม (Nicd):
แบตเตอรี่นิกเกิลแคดเมียมมีข้อได้เปรียบในการชาร์จซ้ำหลายครั้งและมีศักยภาพค่อนข้างคงที่ระหว่างการคายประจุและมีความสามารถในการทนต่อไฟฟ้าและทางกายภาพได้มากกว่า แบตเตอรี่นี้ใช้นิกเกิลออกไซด์สำหรับแคโทดซึ่งเป็นสารประกอบแคดเมียมสำหรับสารละลายแอโนดและโพแทสเซียมไฮดรอกไซด์เป็นอิเล็กโทรไลต์

เมื่อชาร์จแบตเตอรี่องค์ประกอบทางเคมีของแคโทดจะเปลี่ยนรูปและนิกเกิลไฮดรอกไซด์จะเปลี่ยนเป็น NIOOH ในขั้วบวกการก่อตัวของแคดเมียมไอออนเกิดขึ้นจากแคดเมียมไฮดรอกไซด์ เมื่อแบตเตอรี่หมดแคดเมียมจะทำปฏิกิริยากับ NiOOH เพื่อสร้างนิกเกิลไฮดรอกไซด์และแคดเมียมไฮดรอกไซด์กลับคืนมา
Cd + 2H2O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
แบตเตอรี่กรดตะกั่ว:
แบตเตอรี่ตะกั่วกรดใช้กันอย่างแพร่หลายในรถยนต์อินเวอร์เตอร์ระบบไฟฟ้าสำรองเป็นต้นซึ่งแตกต่างจากแบตเตอรี่แบบท่อและไม่ต้องบำรุงรักษาแบตเตอรี่ Lead Acid ต้องการการดูแลและบำรุงรักษาที่เหมาะสมเพื่อยืดอายุการใช้งาน แบตเตอรี่ตะกั่วกรดประกอบด้วยชุดแผ่นที่แช่อยู่ในสารละลายกรดซัลฟิวริก เพลตมีกริดที่ยึดวัสดุที่ใช้งานอยู่ จานแบ่งออกเป็นแผ่นบวกและลบ แผ่นขั้วบวกถือตะกั่วบริสุทธิ์เป็นวัสดุที่ใช้งานได้ในขณะที่ตะกั่วออกไซด์ติดอยู่บนแผ่นลบ

แบตเตอรี่ตะกั่วกรด
แบตเตอรี่ที่ชาร์จไฟจนหมดสามารถปล่อยกระแสไฟฟ้าได้เมื่อเชื่อมต่อกับโหลด ในระหว่างกระบวนการคายประจุกรดซัลฟิวริกจะรวมตัวกับวัสดุที่ใช้งานอยู่บนแผ่นบวกและลบทำให้เกิดตะกั่วซัลเฟต น้ำเป็นขั้นตอนเดียวที่สำคัญที่สุดในการบำรุงรักษาแบตเตอรี่ตะกั่วกรด ความถี่ของน้ำขึ้นอยู่กับการใช้งานวิธีการชาร์จและอุณหภูมิในการทำงาน ในระหว่างกระบวนการอะตอมของไฮโดรเจนจากกรดซัลฟิวริกจะทำปฏิกิริยากับออกซิเจนเพื่อสร้างน้ำ
ส่งผลให้เกิดการปลดปล่อยอิเล็กตรอนจากแผ่นบวกซึ่งจะได้รับการยอมรับจากจานลบ สิ่งนี้นำไปสู่การก่อตัวของศักย์ไฟฟ้าบนแบตเตอรี่ อิเล็กโทรไลต์ในแบตเตอรี่ Lead Acid เป็นส่วนผสมของกรดซัลฟูริกและน้ำซึ่งมีความถ่วงจำเพาะ ความถ่วงจำเพาะคือน้ำหนักของส่วนผสมของกรดและน้ำเมื่อเทียบกับน้ำในปริมาตรที่เท่ากัน ความถ่วงจำเพาะของน้ำที่ปราศจากไอออนบริสุทธิ์คือ 1
แบตเตอรี่ตะกั่วกรดให้กำลังและพลังงานที่คุ้มค่าที่สุดต่อกิโลวัตต์ - ชั่วโมงมีวงจรชีวิตที่ยาวนานที่สุดและมีข้อได้เปรียบด้านสิ่งแวดล้อมอย่างมากเนื่องจากแบตเตอรี่เหล่านี้จะถูกรีไซเคิลในอัตราที่สูงเป็นพิเศษ ไม่มีสารเคมีอื่นใดสามารถสัมผัสโครงสร้างพื้นฐานที่มีอยู่สำหรับการรวบรวมการขนส่งและการรีไซเคิลแบตเตอรี่กรดตะกั่ว
นอกเหนือจากบทความนี้แบตเตอรี่ลิเธียมไอออนจะกล่าวถึงข้อดีและข้อเสีย
การทำงานของแบตเตอรี่ลิเธียม - ไอออน

ปัจจุบันแบตเตอรี่ลิเธียมไอออนเป็นที่นิยมในอุปกรณ์พกพาอิเล็กทรอนิกส์ส่วนใหญ่เช่นโทรศัพท์มือถือแล็ปท็อปกล้องดิจิทัลเป็นต้นเนื่องจากประสิทธิภาพการใช้พลังงานที่ยาวนาน เป็นแบตเตอรี่แบบชาร์จไฟที่ได้รับความนิยมมากที่สุดโดยมีข้อดีเช่นความหนาแน่นของพลังงานที่ดีที่สุดการสูญเสียประจุเล็กน้อยและไม่มีผลต่อหน่วยความจำ แบตเตอรี่ Li-Ion ใช้ลิเธียมไอออนเป็นตัวพาประจุซึ่งเคลื่อนจากขั้วลบไปยังขั้วบวกระหว่างการคายประจุและย้อนกลับเมื่อทำการชาร์จ ในระหว่างการชาร์จกระแสไฟภายนอกจากเครื่องชาร์จจะใช้แรงดันไฟฟ้าเกินกว่าที่แบตเตอรี่ในแบตเตอรี่ สิ่งนี้บังคับให้กระแสไหลในทิศทางย้อนกลับจากขั้วบวกไปยังขั้วลบซึ่งไอออนของลิเธียมฝังอยู่ในวัสดุอิเล็กโทรดที่มีรูพรุนผ่านกระบวนการที่เรียกว่า Intercalation Li- ไอออนผ่านอิเล็กโทรไลต์ที่ไม่ใช่น้ำและไดอะแฟรมคั่น วัสดุอิเล็กโทรดเป็นสารประกอบลิเธียมที่มีการแทรกระหว่างกัน
ขั้วลบของแบตเตอรี่ Li-Ion ประกอบด้วยคาร์บอนและขั้วบวกเป็นโลหะออกไซด์ วัสดุที่ใช้กันมากที่สุดในขั้วลบคือ Graphite ในขณะที่ในขั้วบวกอาจเป็นลิเธียมโคบอลต์ออกไซด์ลิเธียมไอออนฟอสเฟตหรือลิเธียมแมงกานีสออกไซด์ เกลือลิเธียมในตัวทำละลายอินทรีย์ใช้เป็นอิเล็กโทรไลต์ โดยทั่วไปอิเล็กโทรไลต์เป็นส่วนผสมของคาร์บอเนตอินทรีย์เช่นเอทิลีนคาร์บอเนตหรือไดเอทิลคาร์บอเนตที่มีลิเธียมไอออน อิเล็กโทรไลต์ใช้เกลือประจุลบเช่นลิเธียมเฮกซาฟลูออโรฟอสเฟตลิเธียมเฮกซาฟลูออโรอาร์เซเนตโมโนไฮเดรตลิเธียมต่อคลอเรตลิเธียมเฮกซาฟลูออโรบอเรตเป็นต้นขึ้นอยู่กับเกลือที่ใช้แรงดันไฟฟ้าความจุและอายุการใช้งานของแบตเตอรี่จะแตกต่างกันไป ลิเธียมบริสุทธิ์ทำปฏิกิริยากับน้ำอย่างแรงเพื่อสร้างลิเธียมไฮดรอกไซด์และไฮโดรเจนไอออน ดังนั้นอิเล็กโทรไลต์ที่ใช้จึงไม่ใช่ตัวทำละลายอินทรีย์ในน้ำ บทบาททางเคมีไฟฟ้าของประจุไฟฟ้าระหว่างขั้วบวกและแคโทดขึ้นอยู่กับทิศทางของการไหลของกระแส

ปฏิกิริยาของแบตเตอรี่ Li Ion
ในแบตเตอรี่ Li-Ion อิเล็กโทรดทั้งสองสามารถรับและปล่อยไอออนลิเธียมได้ ในระหว่างกระบวนการ Intercalation ลิเธียมไอออนจะเคลื่อนที่เข้าไปในอิเล็กโทรด ในระหว่างกระบวนการย้อนกลับที่เรียกว่า de intercalation ไอออนของลิเธียมจะเคลื่อนที่กลับ ในระหว่างการคายประจุลิเธียมไอออนบวกจะถูกดึงออกจากขั้วลบและใส่เข้าไปในขั้วบวก ในระหว่างกระบวนการชาร์จจะเกิดการเคลื่อนที่ย้อนกลับของลิเธียมไอออน
ข้อดีของแบตเตอรี่ลิเธียม - ไอออน:
แบตเตอรี่ลิเธียมไอออนมีประสิทธิภาพดีกว่าแบตเตอรี่ NiCd และแบตเตอรี่สำรองอื่น ๆ ข้อดีบางประการคือ
- น้ำหนักเบาเมื่อเทียบกับแบตเตอรี่อื่น ๆ ที่มีขนาดใกล้เคียงกัน
- มีให้เลือกหลายรูปแบบรวมถึงทรงแบน
- แรงดันไฟฟ้าวงจรเปิดสูงที่เพิ่มการถ่ายโอนพลังงานที่กระแสไฟฟ้าต่ำ
- ขาดผลของหน่วยความจำ
- อัตราการปลดปล่อยตัวเองต่ำมาก 5-10% ต่อเดือน การคายประจุเองอยู่ที่ประมาณ 30% ในแบตเตอรี่ NiCd และ NiMh
- แบตเตอรี่ที่เป็นมิตรกับสิ่งแวดล้อมโดยไม่มีโลหะลิเธียมฟรี
แต่ด้วยข้อดีเช่นเดียวกับแบตเตอรี่อื่น ๆ แบตเตอรี่ Li-Ion ก็มีข้อเสียเช่นกัน
ข้อเสียของแบตเตอรี่ Li-Ion:
- การสะสมภายในอิเล็กโทรไลต์เมื่อเวลาผ่านไปจะขัดขวางการไหลของประจุ ซึ่งจะเพิ่มความต้านทานภายในของแบตเตอรี่และความสามารถของเซลล์ในการจ่ายกระแสไฟฟ้าจะค่อยๆลดลง
- การชาร์จสูงและอุณหภูมิสูงอาจทำให้สูญเสียความจุ
- เมื่อความร้อนสูงเกินไปแบตเตอรี่ Li-Ion อาจเกิดความร้อนและการแตกของเซลล์
- การปล่อยประจุไฟฟ้าลึกอาจทำให้แบตเตอรี่ Li-Ion ลัดวงจร ดังนั้นเพื่อป้องกันสิ่งนี้บางยี่ห้อจึงมีวงจรปิดภายในที่ปิดแบตเตอรี่เมื่อแรงดันไฟฟ้าสูงกว่าระดับปลอดภัย 3 ถึง 4.2 โวลต์ ในกรณีนี้เมื่อไม่ได้ใช้งานแบตเตอรี่เป็นเวลานานวงจรภายในจะใช้พลังงานและทำให้แบตเตอรี่หมดลงต่ำกว่าแรงดันไฟฟ้าที่ปิดลง ดังนั้นการชาร์จแบตเตอรี่เครื่องชาร์จแบบปกติจึงไม่มีประโยชน์